Reaksi eliminasi ini biasanya jenis reaksi kimia organik di mana sepasang atom atau kelompok atom dikeluarkan atau dilepaskan dari molekul, biasanya melalui reaksi asam, basa, atau logam dan dengan pemanasan pada suhu tinggi . proses ini adalah proses utama dimana senyawa organik yang hanya mengandung ikatan karbon-karbon tunggal (senyawa jenuh) ditransformasikan menjadi senyawa yang mengandung ikatan karbon-karbon rangkap atau tripel (senyawa tak jenuh).
Reaksi eliminasi pada umumnya dikenal dengan jenis atom atau kelompok atom yang meninggalkan molekul. Penghapusan pada atom hidrogen dan atom halogen, misalnya, dikenal sebagai dehydrohalogenation. ketika kedua atom yang meninggalkannya adalah halogen, reaksinya dikenal sebagai dehalogenasi. Demikian pula, penghapusan molekul air, biasanya dari alkohol, dikenal sebagai dehidrasi. ketika kedua atom yang meninggalkannya adalah atom hidrogen, reaksinya dikenal sebagai dehidrogenasi. Reaksi eliminasi juga diklasifikasikan sebagai E1 atau E2, tergantung pada kinetika reaksi. Dalam reaksi E1, laju reaksi sebanding dengan konsentrasi zat yang akan diubah. dalam reaksi E2, laju reaksi sebanding dengan konsentrasi substrat dan zat penghilang. Untuk pembahasan kali ini kita hanya menjelaskan tentang reaksi eliminasi E2. contoh dari reaksi eliminasi adalah sebagai berikut:
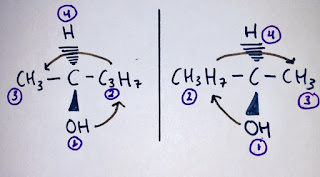
Reaksi E2 biasanya terjadi dengan alkil halida sekunder dan tersier, tetapi basa terhambat diperlukan dengan halida primer. Reaksi E2 ini alkil halidanya cenderung dominan bila digunakan basa kuat dengan temperatur tinggi. Reaksi E2 terjadi dimana prosesnya hanya terjadi satu langkah reaksi bersama dengan satu keadaan transisi dan termasuk reaksi eliminasi bimolekuler. Laju mekanisme ini berlangsung pada kinetika orde kedua, dan tergantung pada basa dan alkil halida. Kelompok yang pergi harus coplanar untuk membentuk ikatan pi. Dalam mekanisme reaksi E2 karbon beralih dari hibridisasi sp3 ke sp2. Mekanisme pada reaksi E2 tidak melewatkan suatu karbokation sebagai zat-antara, melainkan berupa reaksi serempak sama seperti reaksi Sn2. contoh reaksi E2 adalah sebagai berikut:
Pada Mekanisme reaksi E2 diatas dijelaskan bahwa basa (C2H5O) menyerang H pada substrat (isopropil bromida) yang belum terputus atau leaving group belum terlepas dari rantai utamanya. Sehingga pada keadaan transisi terbentuk keadaan dimana basa masih terikat dengan H dari C β namun leaving group nya belum terlepas, sehingga terbentuk ikatan yang masih samar-samar. Dan pada keadaan akhir terbentuk ikatan rangkap dua yang mana pada reaksi diatas terbentuk propena dan CH3CH2OH lepas sebagai etanol kemudian Br lepas menjadi leaving group menjadi ion bromida Br-.
Fassenden. 1986. Kimia Organik Edisi Ketiga Jilid I. Jakarta : Erlangga.
https://www.britannica.com/science/E2-reaction
https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Reactions/Elimination_Reactions/E2_Reactions
Permasalahan :
Referesi :
https://www.britannica.com/science/E2-reaction
https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Supplemental_Modules_(Organic_Chemistry)/Reactions/Elimination_Reactions/E2_Reactions
- Mengapa reaksi eliminasi E2 tidak terjadi pada alkil halida tersier?
- Mengapa pada reaksi eliminasi E2 dominan menggunakan basa kuat bertemperatur tinggi?
- Diatas telah dijelaskan bahwa mekanisme pada reaksi E2 tidak melewatkan suatu karbokation sebagai zat-antara, melainkan berupa reaksi serempak sama halnya seperti reaksi Sn2. Apakah yang membedakan reaksi E2 dengan Reaksi SN2 diluar dari tahap mekanismenya yang sama?