Pada pembahasan kali ini kita akan membahas tentang sifat-sifat dan pembuatan asam karboksilat.
1. Sifat asam karboksilat
Karakteristik kimia utama dari asam karboksilat adalah keasamannya. Mereka umumnya lebih asam dari senyawa organik lain yang mengandung gugus hidroksil tetapi umumnya lebih lemah daripada asam mineral yang dikenal (misalnya, asam klorida, HCl, asam sulfat, H2SO4, dll.).
a. Sifat fisik asam karboksilat
b. Sifat kimia asam karboksilat
Karena ion karboksilat distabilkan oleh resonansi, lebih mudah bagi asam karboksilat untuk melepaskan proton untuk membentuk ion karboksilat.
a. Sifat fisik asam karboksilat
- Asam karboksilat hingga sembilan atom karbon adalah cairan tidak berwarna dengan bau yang tidak sedap. Asam karboksilat yang mengandung lebih dari sembilan atom karbon adalah zat padat tidak berwarna dan tidak berbau karena volatilitasnya yang rendah.
- Titik didih asam karboksilat lebih tinggi daripada aldehida, keton dan alkohol dari massa molekul yang sebanding
- Ikatan O-H dalam asam karboksilat melekat pada gugus karbonil penarik elektron; oleh karena itu, ikatan O-H dalam asam karboksilat lebih terpolarisasi dibandingkan dengan kelompok alkohol O-H.
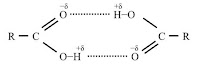
- Karena atom oksigen dari gugus karbonil adalah polar, ia dapat membentuk ikatan-H dengan atom hidrogen O-H dari molekul lain. Ikatan hidrogen ini sangat kuat sehingga tidak putus sepenuhnya bahkan dalam fase uap. Akibatnya, sebagian besar asam karboksilat ada sebagai dimer dalam fase uap atau dalam pelarut aprotik.
- Kelarutan dalam air: Asam karboksilat yang mengandung hingga empat atom karbon larut dalam air karena mereka membentuk ikatan H dengan air. Kelarutan berkurang dengan meningkatnya jumlah atom karbon.
- Kelarutan dalam pelarut organik: Asam karboksilat larut dalam pelarut organik yang kurang polar seperti benzena, eter, alkohol, dll.
b. Sifat kimia asam karboksilat
- Asam karboksilat adalah asam yang lebih kuat daripada alkohol karena basa konjugat (produk yang tersisa setelah dihilangkannya hidrogen) dari asam karboksilat distabilkan oleh resonansi.
Ion alkoksida, di sisi lain, tidak menunjukkan resonansi; oleh karena itu, ini kurang stabil.
Dengan kata lain, alkohol tidak melepaskan proton dengan mudah untuk membentuk ion alkoksida yang kurang stabil; karena itu, alkohol kurang asam.
- Karbon α milik asam karboksilat dapat dengan mudah dihalogenasi melalui reaksi Hell-Volhard-Zelinsky.
- Senyawa ini dapat diubah menjadi amina menggunakan reaksi Schmidt.
- Asam alkanoat merupakan asam lemah. Semakin banyak atom Cyang dimiliki, semakin lemah asamnya. Asam alkanoat terkuatadalah asam metanoat.
- Jika suatu asam alkanoat direaksikan dengan basa, atom H dari guguskarboksil dapat dengan mudah disubstitusi oleh atom logam,sehingga terbentuk garam, Karena garam tersebut terbentuk dari suatu asam lemah, makalarutannya dalam air dihidrolisis oleh H2O sehingga bersifat alkalis.
- Jika suatu asam alkanoat direaksikan dengan suatu alkohol, dengan pengaruh asam sulfat pekat sebagai pengikat air, atom H dari gugus COOH dapat diganti dengan gugus alkil sehingga terbentuk suatu ester. Reaksi ini disebut dengan reaksi esterifikasi. Ester yangdihasilkan oleh reaksi esterifikasi ini merupakan suatu non-elektrolit.
Sejumlah besar jalur sintetik untuk mendapatkan asamkarboksilat dapat dikelompokkan dalam tiga tipe raksi: (1) hidrolisis devirat asam karboksilat; (2) reaksi oksidasi; (3) reaksi Grinard.
A. Hidrolisis Devirat Asam Karboksilat
Hidrolisis devirat asam karboksilat terjadi dari serangan air atau OH-pada karbon karbonil (atau karbon –CN pada suatu nitril) dari devirat itu. Hidrolisis suatu ester yang menghasilkan suatu asam karboksilat dan alcohol adalah khas dari kelompok reaksi ini. Salah satu contoh derivat menghasilkan asam karboksilat adalah:
Hidrolisis Nitril (Sianida Organik)
Apabila alkil sianida (nitril) dididihkan dengan katalis asam akan terbentuk asam alkanoat. Pada reaksi ini terbentuk amonia.
B. Reaksi Oksidasi
1. Oksidasi Alkohol Primer
Pada umunya zat pengoksidasi laboratorium mengoksidasi alkohol primer menjadi asam karboksilat. Beberapa zat pengoksidasi yang khas untuk oksidasi ini adalah:
a) kalium permanganat basa: KMnO4 + −OH
b) HNO3 pekat dan panas
c) asam kromat: H2CrO4 (dibuat insitu dari CrO3 atau Cr2O7 dengan H2SO4 dalam air)
d) kromium trioksida (CrO3) yang dikomplekskan dengan piridina atau piridina dengan HCl
1. Oksidasi Alkohol Primer
Pada umunya zat pengoksidasi laboratorium mengoksidasi alkohol primer menjadi asam karboksilat. Beberapa zat pengoksidasi yang khas untuk oksidasi ini adalah:
a) kalium permanganat basa: KMnO4 + −OH
b) HNO3 pekat dan panas
c) asam kromat: H2CrO4 (dibuat insitu dari CrO3 atau Cr2O7 dengan H2SO4 dalam air)
d) kromium trioksida (CrO3) yang dikomplekskan dengan piridina atau piridina dengan HCl
Alhohol primer mula-mula dioksidasi dulu menjadi aldehida. Aldehida lebih mudah dioksidasi daripada alkohol. Oleh karena itu biasanya oksidasi tidak terhenti, melainkan terus sampai terbentuk asam karboksilat (atau anion karboksilat dalam larutan basa).
Referensi :
|
Permasalahan : 1. Salah satu sifat fisik asam karboksilat adalah titik didih asam karboksilat lebih tinggi daripada aldehida, keton dan alkohol dari massa molekul yang sebanding atau bobot molekul yang sama. Apa yang menyebabkan hal itu bisa terjadi? 2. Jika suatu asam alkanoat direaksikan dengan suatu alkohol, dengan pengaruh asam sulfat pekat (katalis asam) maka akan menghasilkan senyawa ester. Bagaimana jika asam alkanoat ini direaksikan dengan suatu alkohol menggunakan katalis basa? 3. Apa yang menyebabkan Asam karboksilat pada kelarutan dalam air akan berkurang dengan meningkatnya jumlah atom karbon? |









Baiklah, saya Vika Seputri Nim A1C118086 akan mencoba menjawab permasalahan no.3 yaitu Apa yang menyebabkan Asam karboksilat pada kelarutan dalam air akan berkurang dengan meningkatnya jumlah atom karbon? Karena Adanya rantai bercabang yang menyebabkan kelarutan makin menurun.
BalasHapusTerimakasih
Hai nabilah
BalasHapusSaya M Rizki Dwi Putra NIM A1C118006, menjawab permasalahan nomor 2 apabila suatu asam alkanoat disaksikan dengan alkohol menggunakan katalis basa maka reaksi pembentukan produk metil ester akan berjalan tidak optimal dikarenakan bahwa tidak adanya proton H+ yang dimiliki suatu basa.
Baiklah, saya khusnul khotimah (039) akan mencoba menjawab permasalahan no 1. Titik didih asam karboksilat memang lebih tinggi dibandingkan alkohol,aldehid dan keton. Hal ini disebabkan adanya ikatan hidrogen antara 2 molekul. Dan semakin panjang gugus R nya, maka akan semakin tinggi titik didihnya
BalasHapus