Kelas penting senyawa organik yang dikenal sebagai alkohol, fenol, eter, amina dan halida terdiri dari gugus alkil dan / atau aril yang berikatan dengan masing-masing substituen hidroksil, alkoksil, amino dan halo. Jika gugus-gugus fungsi yang sama ini melekat pada gugus asil (RCO-) sifat-sifatnya secara substansial berubah, dan mereka ditetapkan sebagai turunan asam karboksilat. Asam karboksilat memiliki gugus hidroksil yang terikat pada gugus asil, dan turunan fungsionalnya disiapkan dengan penggantian gugus hidroksil dengan substituen, seperti halo, alkoksil, amino, dan asiloksi. Turunan asam karboksilat semua dapat dihidrolisis menjadi asam karboksilat. Kondisi reaksi spesifik dibahas dalam bab yang sesuai kemudian dalam teks ini, namun, pola reaktivitas kimia bersama dirangkum dalam diagram di bawah ini.
Reaksi substitusi asil nukleofilik terjadi dalam dua tahap, yaitu adisi nukleofilik dan eliminasi 'leaving group'. Kedua tahap tersebut dapat mempengaruhi kelajuan reaksi secara keseluruhan. Meskipun demikian, secara tahap pertama adalah merupakan tahap penentu laju, dan baik efek sterik maupun elektronik merupakan factor yang penting dalam menentukan reaktivitas. Secara sterik, dalam satu seri turunan asam karboksilat yang sama, maka gugus karbonil yang lebih terhalangi akan diserang lebih lambat disbanding gugus yang sterik tak terhalangi.
Secara elektronik, turunan asam yang lebih polar diserang lebih cepat dibandingkan kurang polar.
2. Sifat Spektral Turunan Asam Karboksilat
Spektra nmr dari derivat asam karboksilat menyajikan sedikitinformasi mengenai fungsionalitas dalam senyawa-senyawa ini. Isyarat untuk hidrogen α dari senyawa karbonil ini tergeser sedikit kebawah-medan dari isyarat untuk hidrogen alifatik biasa karena berkurangnya pemerisaian oleh atom karbon karbonil yang bermuatan positif parsial. Perhatikan bahwa hidrogen α dari suatu asam klorida menunjukkan geseran kimia yang lebih besar daripada hidrogen α derivat asam lainnya. Geseran kimia yang besar ini timbul karena lebih besarnya kemampuan Cl (dibandingkan O atau N) untuk menarik rapatan electron dari ikatan didekatnya.
Spektra ir dari derivat asam memberikan lebih banyak informasi mengenai tipe gugus fungsional daripada yang diberikan oleh spektra nmr. Kecuali untuk nitril, sifat utama yang khusus dari spektra ir semua derivat asam karboksilat ialah absorpsi karbonil pada sekitar 1630-1840 cm-1 (5,4-6 μm). Anhidrida dan ester juga menunjukkan absorpsi C−O dalam daerah 1050-1250 cm-1 (8-9,5 μm).
a) Klorida Asam
Absorpsi inframerah karbonil dari klorida asam dijumpai pada frequensi yang sedikit lebih tinggi daripada resapan untuk derivat asam lain. Tidak ada lagi sifat khusus lain dalam spectrum inframerah yang menandakan bahwa “inilah klorida asam.”
b) Anhidrida
Anhidrida asam karboksilat mempunyai dua gugus C═O, umunya menunjukkan peak karbonil rangkap dalam spectrum irnya. Anhidrida juga menunjukkan suatu pita uluran C−O sekitar 1100 cm-1 (9 μm).
c) Ester
Absorpsi ir karbonil dari ester alifatik dijumpai sekitar 1740 cm-1 (5,75μm). Namun ester terkonjugasi (baik ester tak jenuh –α,β ataupun ester α−aril). Menyerap pada frequensi sedikit lebih rendah, sekitar 1725 cm-1 (5,8 μm). Ester juga menunjukkan absorpsi uluran C−O dalam daerah sidik jari.
d) Amida
Posisi resapan gugus karbonil suatu amida beranekaragam dan bergantung pada sejauh mana pengikat – hidrogen antara molekul-molekul. Spektrum ir dari suatu amida cair murni (pengikat hidrogen maksimum) menunjukkan suatu peak yang disebut pita amida I sekitar 1650 cm-1 (6,0μm). Pita amida II tampak antara 1515-1670 cm-1 (6,0-6,6 μm), tepat disebelah kanan resapan C═O. Resapan ini ditimbulkan dari tekukan NH. Oleh karena itu amida terdistribusi, atau tersier, tidak menunjukkan pita II ini. Vibrasi uluran NH menimbulkan resapan disebelah kiri absorpsi CH alifatik pada 3125-3570 cm-1 (2,8-3,2 μm). (Kira-kira daerah ini sama dengan daerah dimana NH amina dan OH menyerap). Amida primer (RCONH2) menunjukkan peak rangkap dalam daerah ini. Amida sekunder (RCONHR), dengan hanya satu ikatan, menunjukkan suatu peak tunggal. Amida tersier (RCONR2), tanpa NH, tidak menunjukkan resapan dalam daerah ini.
e) Nitril
Resapan C≡N dijumpai dalam daerah ikatan rangkap tiga dari spectrum ir 2200-2300 cm-1 (4,3-4,5 μm) dan dengan intensitas antar medium ke lemah.
DERIVAT ASAM KARBOKSILAT
Nama sistematik ester diturunkan dengan pertama-tama menyebut nama gugus alkil dari alkohol, kemudian menyebutkan asam karboksilatnya.
1.
Asil klorida
1.1 Tata nama
Asil halide diberi nama dengan menyebutkan gugus
asilnya, dan kemudian kan halidanya.
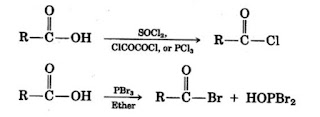
1.2. Pembuatan asil halida
Asil halida dapat dibuat dari reaksi antara asam
karboksilat dengan tionil klorida (SOCl2),
Fosfor triklorida (PCl3), oksalil
klorida (ClCOCOCl). Sebagai Contoh:
Reaksi ini terjadi melalui substitusi asil
nukleofilik, di mana asam karboksilat diubah
menjadi suatu turunan yang reaktif, yang mana kemudian diserang.
1.3 Reaksi-reaksi asil halida
Asil halida merupakan turunan asam karboksilat yang paling
reaktif dan menjalani
reaksi-reaksi yang sangat
berguna (Gambar 4.4.).
Sebagian besar reaksi-reaksi asil halida terjadi melalui
substitusi asil nukleofilik.
2. Anhidrida Asam
2.1 Tata nama
Anhidrida
simetris dari asam
monokarboksilat rantai lurus
dan anhidrida siklik dari asam dikarboksilat diberi nama
dengan mengganti kata asam dengan hidrida.
Jika anhidrida diturunkan dari asam
monokarboksilat yang tersubstitusi,
penamaannya dengan menambahkan awalan bis- pada nama asamnya.
2.2 Pembuatan anhidrida asam
Metode yang paling umum untuk membuat anhidrida
asam adalah melalui aksi substitusi nukleofilik asil antara suatu asil halida
dan garam karboksilat. Baik anhidrida simetris dan tak simetris dapat dibuat
dengan cara ini dengan ademen yang tinggi.
2.3 Reaksi-reaksi anhidrida
Kimiawi
dari anhidrida asam
hampir sama dengan
asil halida. Anhidrida
asam bereaksi lebih lambat
dari pada asil
halida, tetapi macam
reaksi yang dijalani
adalah sama. Jadi,
anhidrida asam bereaksi
dengan air membentuk
asam, dengan alkohol membentuk ester, dengan amina membentuk amida, dan direduksi
oleh LiAiH4 sebagai berikut:
3. Ester
3.1 Tata nama Nama sistematik ester diturunkan dengan pertama-tama menyebut nama gugus alkil dari alkohol, kemudian menyebutkan asam karboksilatnya.

3.2.2 Esterifikasi Fishcher antara asam karboksilat dengan alcohol dengan bobot molekul rendah dengan adanya katalis asam mineral.
Reaksi esterifikasi Fischer merupakan contoh yang paling dikenal dari reaksi substitusi asil nukleofilik yang dijalankan dalam suasana asam. Protonasi oksigen karbonil yang bersifat basa mengaktivasi asam karboksilat terhadap serangan nukleofilik oleh alkohol, dan kehilangan air sesudah itu akan menghasilkan produk ester. Hasil nettonya adalah substitusi -OH oleh -OR1. Semua step adalah reversibel. Mekanisme esterifikasi Fisher ini ditunjukkan dalam Gambar 4.4.
Reaksi esterifikasi Fischer merupakan contoh yang paling dikenal dari reaksi substitusi asil nukleofilik yang dijalankan dalam suasana asam. Protonasi oksigen karbonil yang bersifat basa mengaktivasi asam karboksilat terhadap serangan nukleofilik oleh alkohol, dan kehilangan air sesudah itu akan menghasilkan produk ester. Hasil nettonya adalah substitusi -OH oleh -OR1. Semua step adalah reversibel. Mekanisme esterifikasi Fisher ini ditunjukkan dalam Gambar 4.4.
3.2.3 Metil ester dapat dibuat dari reaksi antara asam karboksilat dan diazometan, CH2N2.
Proses ini tidak melibatkan reaksi substitusi asil nukleofilik, karena yang terputus adalah ikatan -COO-H dari asam karboksilat. 3.3 Reaksi-reaksi terhadap ester
Ester menunjukkan reaksi-reaksi yang sama dengan turunan asam yang lain, tetapi mereka kurang reaktif terhadap nukleofil dari pada asil halida dan anhidra asam. Bagan berikut ini menunjukkan reaksi umum dari ester. Semua reaksi tersebut dapat berlaku baik pada asiklik ester atau siklik ester (lakton).
3.3.1 Hidrolisis
Ester terhidrolisis baik dalam suasana basa atau asam menghasilkan fragmen asam karboksilat dan alkohol. Reaksi hidrolisis ester ini terjadi melalui mekanisme substitusi asil nukleofilik. Hidrolisis ester dalam alkali berikut ini disebut saponifikasi (sapo = sabun).

Permasalahan :
1. Pada reaksi hidrolisis yang saya paparkan ester terhidrolisis baik dalam suasana basa menghasilkan fragmen asam karboksilat dan alkohol. Bagaimana pada reaksi hidrolisis ester ini jika dilakukan dalam suasana asam? Apakah akan menghasilkan produk yang sama yaitu asam karboksilat dan alkohol?
2. Mengapa anhidra asam bereaksi lebih lambat dari pada asil halida padahal kimiawi dari anidrida asam hampir sama dengan asil halida?
3. Mengapa Asil halida merupakan turunan asam karboksilat yang paling reaktif?















Saya mashita NIM A1C118083 akan mencoba menjawab pertanyaan no 2
BalasHapusKarena asil halida adalah senyawa agak reaktif, senyawa ini memiliki sifat racun dan harus berhati-hati. Asil halida dapat beraksi dengan air pada permukaan mata dan membentuk asam halida dan asam organik yang mengiritasi mata.
ERMA JOHAR A1C118031
BalasHapusbaiklah saya akan menjawab no 3 , karena dapat dengan mudah diubah menjadi semua turunan asam karboksilat lainnya . Untuk reaksi turunan nya bisa dilihat di blog saya
Ermawati ( A1C118002)
BalasHapusSaya Ermawati ingin mencoba menjawab permasalahan nomor 1 yang saudari ajukan.
Menurut saya jika reaksi hidrolisis ester ini dilakukan dalam suasana asam akan tetap menghasilkan produk yang sama seperti jika dilakukan dalam suasana basa yaitu asam karboksilat dan alkohol. Hal hal ini karena ester terhidrolisis baik dalam suasana basa ataupun asam akan tetap menghasilkan produk yang sama.
Terimakasih